MÉTODOS
PROTOCOLO DE EXTRACCIÓN DE ADN (MINIPREP)
Extracción de ADN
- En un tubo Eppendorf de 2 ml. Machacar hojas en nitrógeno líquido. Luego agregar 800 µl de buffer de extracción.
- Incubar a 65 °C durante 30 min, invertir regularmente los tubos durante este período.
- Agregar 400 µl de cloroformo e invertir los tubos regularmente. Dejar 10-15 min a temperatura ambiente.
- Centrifugar a 12.000 rpm durante 10 min.
- Tomar 600 µl del sobrenadante (fase acuosa) y colocarlo en tubo Eppendorf de 1,5 ml para precipitar el ADN con 0,8 volúmenes de isopropanol (480 µl). El isopropanol tiene que estar a temperatura ambiente. Después de agregarlo, invertir el tubo unas diez veces suavemente para que se mezcle y centrifugar 2 min a 10.000 rpm (con el isopropanol precipitan otras cosas además del ADN por eso se utiliza a temperatura ambiente y poco tiempo).
- Eliminar el sobrenadante y limpiar el pellet con 600 µl de etanol al 70%. Centrifugar 2 min a 10.000 rpm. Eliminar el sobrenadante.
- Secar el pellet a temperatura ambiente durante una hora. Resuspender el ADN en 50-100 µl de TE conteniendo 20 µg/ml de ARNasa (stock ARNasa 10 mg/ml).
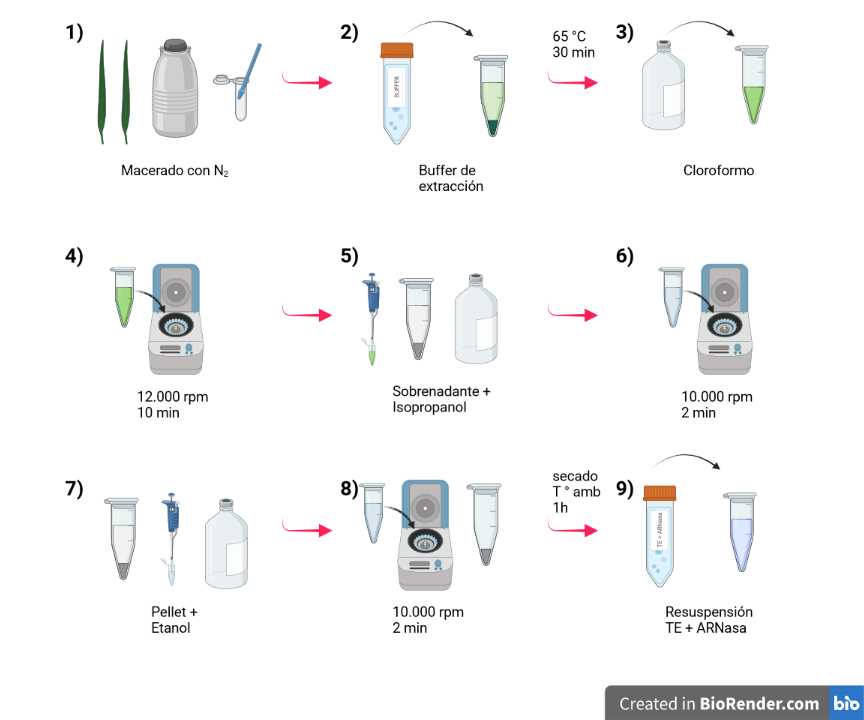
Figura: Se muestra esquemáticamente los pasos de la extracción de ADN de hojas de trigo
Buffer de extracción
100 mM Tris HCl pH 8
1,4 M NaCl
20 mM EDTA pH 8
2% (w/v) CTAB (agregar primero el agua, calentarla y luego agregar el CTAB para mejorar la disolución)
β-mercaptoetanol 0,5 ml/100 ml de buffer (agregarlo antes de utilizar)